对将于2019年12月1日起实施的新版药品管理法,埃林哲行业研究院对此法进行了深入分析,得到了一些成果,在这里希望和大家一起分享。
作为信息化系统的建设者,我们需要看到新修订的药品管理法对于信息系统的影响。从新修订的药品管理法来看,新增了二,三,七,九这四个章节,贯穿了药品研制、生产、经营、使用、上市后管理等各个环节,对各环节的监管监督更严格,“药品上市许可持有人”的提出更是落实药品全生命周期的主体责任。因此,任何的医药信息系统都逃不过“合规”二字。满足合规其实也就是在各个环节做到质量控制,医药企业的管理流程简单来看就是研发——生产——经营——上市后管理等。接下来,按照流程顺序为大家进行阐述。
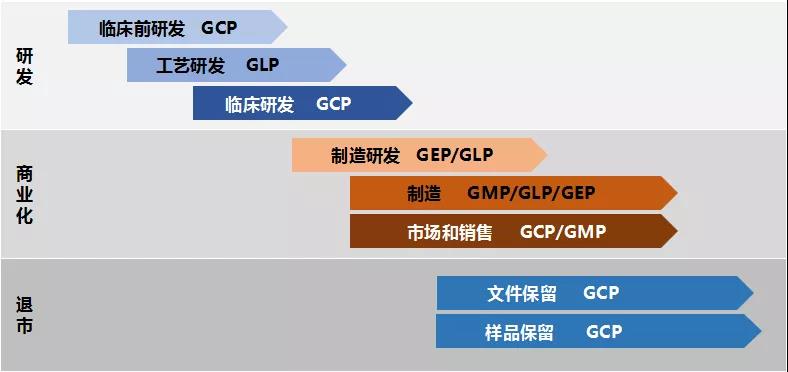
全流程所需的质量规范总结1-1
药品研制注册:合规性要求进一步提高
从研发来看,新修订的药品管理法着重对于临床实验和药品注册进行了法规内容的增加和修改。新修订的药品管理法里面规定,药品研制必须遵循药物非临床研究质量管理规范(GLP),药物临床试验质量管理规范(GCP)。 埃林哲行业专家对此的建议是,在信息系统方面,为研发管理配套符合法规要求的LIMS系统等,通过提高信息系统的合规性来促进企业药品研发的合规建设。
埃林哲行业研究院注意到,药品注册证也发生了不小的变化,在旧版法规中,只有进口药品才需要有药品注册证书,而在新修订的这版法规中,所有(只要在中国境内上市)的药品都需要药品注册证书,在医疗器械行业中,也有类似的医疗器械注册证管理。
药品生产经营:GSP,GMP认证取消,企业信息化建设如何应对?
在药品生产章节,大家关注的GMP证书取消了,那建立的系统会有变化吗?埃林哲行业专家表示系统不会产生太大变化,虽然企业不用再费很多心力去进行GMP认证,但是GMP(“药品生产质量管理规范”)仍然存在,企业仍需要严格遵守本项规范。未来,政府相关部门必然会加大对各药品生产企业的飞行检查,所以一个符合GMP规范的信息系统仍是必须的。
针对药品经营,我们关注点首先仍是在于GSP认证的取消,与GMP类似,证书取消了,但是“药品经营质量管理规范”还在。
药品经营:网络销售平台合规管理解决之道在于加强资质审查
其他方面值得注意的是网络销售平台的建立,新修订法规重点强调了对进入平台企业的管理要求。埃林哲行业专家建议,进行信息化系统设计时,在中台增加资质证照管理的功能。既有效加强对入驻平台的药品上市许可持有人、药品经营企业的管理,又保证平台的经营销售活动是合法合规的。
药品上市后管理:取得数据的准确性和及时性很重要
药品在取得注册证书上市之后,药品上市许可持有人需要及时准确地搜集上市后的药品相关数据,比如产品的不良监测信息,召回信息,附条件批准的商品等。埃林哲行业研究院分析:针对该数据的搜集,可以通过企业本身的信息系统与下游企业的ERP等信息系统进行对接,实时获取相关数据,通过系统传输效率更高,准确度更好,符合了国家对于药品进一步的风险管控。
当药品上市后,在定期的上市评价中,发现药品有问题(包括疗效不确切、不良反应大或者因其他原因危害人体健康),会注销该药品注册证书。埃林哲行业研究院注意到,如果药品注册证书被取消,该药品的库存必须全部销毁或处理。
在新修订的药品管理法中,药品监督管理部门未来对企业药品进行抽样检查时,抽样样品会进行购买,对于药品生产经营企业讲,这部分的支出就会产生相应的变化,以前企业无偿提供样品,在系统中对应的操作就是产生抽样单,然后直接扣减库存,财务直接进入部门费用;但是现在抽样样品需要按照销售进行管理。对此,埃林哲行业研究院分析:一般情况,在系统中会进行客户的经营范围控制,药品销售给医院等医疗机构以及一些零售药店时,系统中会进行客户经营许可资质核查。而药品监督管理部门不是药品经营企业,企业又有药品监督管理部门作为客户的需求,埃林哲行业专家建议在系统中取消对药品监督管理部门经营范围的设定。
总的来看,埃林哲行业研究院认为本次修订案对企业信息化系统的影响主要出现在药品研发合规性,网络销售平台合规性以及药品上市后的风险管理。埃林哲行业专家对于新的法律在信息化方面带来的冲击和影响,我们该如何改变,也做了深入的研究和梳理,请大家敬请期待后续的解读。












 沪公网安备:31010502004192号
沪公网安备:31010502004192号

